Как зарегистрировать лекарства по всем правилам ЕАЭС?
1 января 2015 года был создан Евразийский экономический союз (ЕАЭС) для объединения стран в единое экономическое пространство во многих отраслях экономики. В состав ЕАЭС входят: Россия, Беларусь, Казахстан, Армения и Кыргызстан. В ходе работы по упрощению взаимодействия и увеличения товарооборота между странами были разработаны единые процедуры во многих отраслях экономика.
В частности в соответствии с Договором о Евразийском экономическом союзе от 29 мая 2014 года, Соглашением о единых принципах и правилах обращения лекарственных средств в рамках Евразийского экономического союза от 23 декабря 2014 года, Решением Совета Евразийской экономической комиссии от 3 ноября 2016 г. № 78 «О Правилах регистрации и экспертизы лекарственных средств для медицинского применения», Решением Совета Евразийской экономической комиссии от 03.11.2016 N 88 «Об утверждении требований к инструкции по медицинскому применению лекарственных препаратов и общей характеристике лекарственных препаратов для медицинского применения», с 2021 года все страны-участницы ЕАЭС обязаны проводить регистрацию лекарственных средств (ЛС) по единым правилам. После этого они вносятся в Единый реестр медицинских средств. Следование единым правилам повышает доступность препаратов в этих странах, а значит улучшает качество жизни населения ЕАЭС.
Как происходит регистрация лекарств?
Чтобы зарегистрировать медицинский препарат по всем правилам ЕАЭС,и он был внесен в официальный реестр, производитель должен пройти через определенную процедуру:
- Приведение всей документации в соответствии с новыми требованиями.
- Прохождение необходимых клинических исследований.
- Сбор регистрационного досье и его передача в Министерство здравоохранения.
- Минздрав проводит проверку ЛС на качество, безопасность, а также эффективность. Возможен выезд инспекции на производство.
- Если решение положительное, то производитель оплачивает государственные пошлины стран, где планируется продавать лекарственное средство.
- Страны, где будет продаваться медикамент, должны согласовать результаты экспертизы.
Этапы регистрации
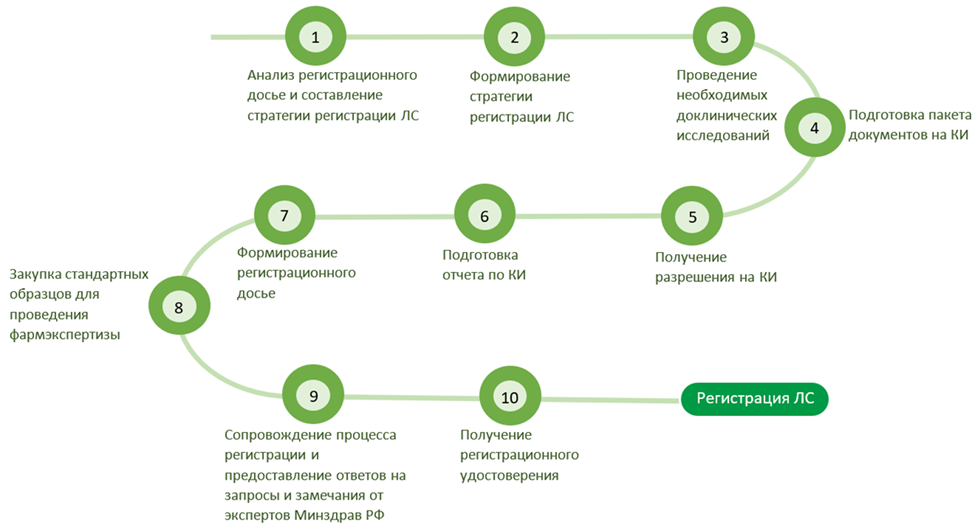
По окончании процедуры производитель получает регистрационное удостоверение на ЛС Евразийского экономического союза действительное во всех странах ЕАЭС.
Агентство ResearchView предлагает полный перечень услуг по подготовке и подаче регистрационного досье, включая подготовку документов и ответы на запросы от экспертов Минздрава РФ:
- Анализ нормативной документации;
- Разработка проекта общей характеристики лекарственного препарата;
- Разработка проекта листка-вкладыша;
- Организация проведения и подготовка отчета пользовательского тестирования листка-вкладыша;
- Рекомендации по оценке комплектности и содержания разделов регистрационного досье;
- Подготовка заявления на государственную регистрацию;
- Подготовка электронной версии и форматирование регистрационного досье в xml-формате;
- Валидация подготовленного регистрационного досье в кабинете заявителя, подача комплекта документов в Министерство здравоохранения;
- Консультативная помощь Заказчику при подготовке документов для ответа на запрос уполномоченного органа;
- Комплектация документов и форматирование регистрационного досье в xml-формате в рамках ответа на запрос/-ы;
- Получение решения о направлении на фармацевтическую экспертизу;
- Мониторинг фармацевтической экспертизы;
- Консультативная помощь Заказчику при подготовке документов для ответа на запрос/-ы уполномоченного органа,
- Комплектация документов и создание новой электронной версии регистрационного досье в xml-формате и подача комплекта документов в ответ на запросы уполномоченного органа;
- Мониторинг экспертизы после подачи ответа на запрос/-ы уполномоченного органа;
- Получение утвержденного комплекта документов Министерством здравоохранения вместе с регистрационным удостоверением по окончании экспертизы.
Свяжитесь с нами, оставив свои данные в форме обратной связи, или позвонив нам по контактному номеру телефона.
Для получения дополнительной информации обращайтесь в агентство Дайнемик Коммуникейшнс / Dynamic Communications по адресу http://dynamicmoscow.com







